医疗器械洁净车间及实验室设计审评
1/5

医疗器械洁净车间及实验室设计审评
¥0.00/普通
2013-09-10 11:0215分享0询价
参数
- 汇龙品牌
- 1普通起订
- 深圳产地
广东 深圳
0天内发货
0普通
产品参数
- 汇龙
- 广东 深圳
- 1普通
产品详情
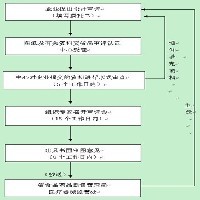
产品介绍医疗器械洁净车间及实验室设计主要依据《医疗器械生产质量管理规范》和《体外诊断试剂生产实施细则》、《医疗器械洁净室(区)检查要点指南(2013版)、《无菌医疗器具生产管理规范》(YY0033-2000)的相关要求为主,部分借鉴了《医药工业洁净厂房设计规范》(GB50457-2008)、《洁净室及相关受控环境 第3部分:检测方法》(GB/T 25915.3-2010)等国家标准的相关要求。产品属性二、需提交的资料(一式六份):1、委托书.doc2*、设计说明书; 3、拟生产产品目录、工艺流程简述及简图(不同产品需分别列出);4、生产厂区总平面图(生产厂区包括生产车间、检验场地及与生产相关的仓库等辅助场地);5、生产车间平面布置图(包括更衣室、盥洗间、人流和物流通道、气闸等,并标明人、物流向和空气洁净度等级); 6、中心化验室平面布局图(包括阳性对照间、无菌检验室、微生物限度实验室等各功能间);7、仓库平面布局图(包括原辅料仓、常温库等);8、生产车间及中心化验室空气净化系统的送风、回风、排风平面布置图;9、工艺设备平面布置图;10、主要生产设备、检验仪器一览表(含设备和仪器名称、型号、数量);11、其他相关资料。注:设计说明书内容:(1)总说明:概述、设计依据、设计原则、设计范围、产品方案及设计规模、综合技术指标等;(2)工艺技术:设计依据、设计原则、生产流程图、工艺流程简述、主要工艺设备选型、设备安装、生产制度及车间岗位定员、物料衡算、辅助设施、设备一览表等;(3)车间布置及内部装修:车间布置(布置说明、人流途径、物流途径、设备安装)、内部装修(地面、间隔墙、天花、门窗、内墙面、柱面、地漏)等;(4)空调、通风:设计依据、设计范围、设计参数、设计方案、空调设备一览表、空调风量平衡表(5)公用工程:供纯化水、供配电、供压缩空气、给排水(6)仓库、检验室(7)劳动安全及工业卫生(8)消防、环境保护、法规执行情况其他说明省食品药品监督管理局医疗器械监管处(广东省食品药品监督管理局审评认证中心)公布的:医疗器械生产企业建设项目(新建、改建、扩建)设计审评工作程序一、工作程序及时限1、医疗器械生产企业将委托相关专业设计部门进行设计(加盖设计部门出图专用章)或自行设计的图纸(加盖企业公章)和资料交广东省食品药品监督管理局审评认证中心进行审评,审评结果抄送省食品药品监督管理局医疗器械监管处。2、审评认证中心在收到企业图纸和相关资料后,应于5个工作日内对企业提交的资料进行形式审查(如资料不全者,应通知企业及时补充),并于15个工作日内组织审评会。3、审评会结束后,审评认证中心应于8个工作日内出具审图意见,抄送企业和设计单位,并抄送省食品药品监督管理局医疗器械监管处(广东省食品药品监督管理局审评认证中心地址:广州市东风东路753号之二,电话:020-37886298)交易说明出初步工艺布局图--到省局预审--让他改工艺平面图--OK了然后进行后续设计--送审并修改--预算施工--调试

在线留言
店铺最新

- 医疗器械洁净车间及实验室设计审评
- ¥0.00
 在线问
在线问
最近来访记录
美国 加利福尼亚州圣克拉拉县山景市谷歌公司网友 02-18 05:35 用安卓手机在谷歌浏览器上访问了本页
河北省张家口市网友 01-11 04:44 用安卓手机在Safari上访问了本页









